来源:生物制药小编
作者 l OVs 编辑 l 细胞房间
概述
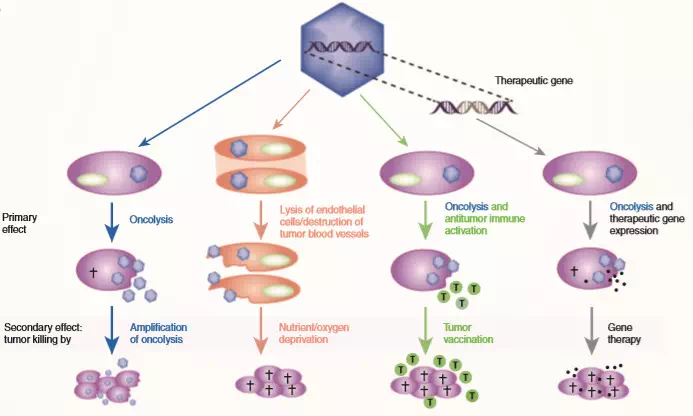
▲图1. 溶瘤病毒抗肿瘤机理
溶瘤病毒的选择标准

▲表1. 溶瘤病毒种类及特征
溶瘤病毒的选择及设计需考虑以下因素:
病毒基因组:DNA病毒通常更易于遗传操作,临床经验更为丰富,但比RNA病毒更容易出现中和抗体。相比之下,尽管RNA病毒遗传操作更具挑战性,但它们的复制效率更高,从而导致更大的局部扩增。RNA病毒机体免疫力较低方便静脉注射。
病毒大小:较大的病毒可以容纳较大的外源基因,但它们不太可能穿透血脑屏障。较小的病毒可能不适合基因操作,但它们能更有效地穿透肿瘤,穿过血脑屏障,这对肿瘤靶向治疗十分有利,如原发性脑肿瘤的治疗。
病毒的致病性:许多病毒可引起人类疾病,对于毒力较低的病毒,如1型单纯疱疹病毒(HSV-1)或腺病毒(尤其是减活病毒)用于肿瘤治疗,是可以接受的。病毒是免疫反应的有力刺激物,诱导强烈免疫反应的病毒可能介导较强的抗肿瘤免疫,但它们也可能更快地被免疫系统清除,从而限制了其使用剂量。因此,具有较高免疫原性的病毒可能更适合于瘤内注射,而具有较低免疫原性的病毒更适合于静脉注射。
细胞进入机制:病毒必须能够进入肿瘤靶细胞才能发挥其抗肿瘤活性,因此,肿瘤细胞上的细胞进入受体是决定病毒靶向性的关键因素。
病毒的稳定性:病毒在各种临床环境中的储存、制备和运输必须是稳定的,且必须能够达到高滴度,以确保药物在肿瘤微环境中的分布。
prime-boost策略:即最初使用一个或几个剂量的一种病毒免疫,然后使用不同的病毒作为增强剂量。prime-boost法的潜在优势包括降低病毒免疫原性,确保外源基因高效表达,以驱动肿瘤细胞杀伤或增强抗肿瘤免疫。
另外,与其它作用机制药物的联合用药也是一个重要的考虑因素。
免疫检查点及其抑制剂
癌症免疫治疗和免疫检查点抑制剂的出现改变了许多癌症的治疗方式,它们可阻断肿瘤细胞的免疫逃逸,持续激活抗肿瘤免疫反应。正常情况下免疫系统可以自行杀灭肿瘤细胞,但肿瘤细胞可以通过多种方式逃脱免疫系统的追杀,而这叫做“免疫逃逸”。
T淋巴细胞是免疫系统里的重要成员(图2所示),T淋巴细胞右侧红色标注为抑制性受体,相当于T淋巴细胞的“刹车系统”,该类受体被结合后T淋巴细胞就无法激活,无法发挥抗肿瘤等作用。但肿瘤细胞比较狡猾,它看到T细胞上有个叫做PD-1的蛋白,便表达一个PD-L1蛋白(是PD-1的配体),当PD-1与PD-L结合后,便踩了T淋巴细胞的“刹车系统”,诱导T细胞凋亡、抑制T细胞的活化和增殖,从而使肿瘤细胞逃脱T淋巴细胞的追杀,逍遥法外。
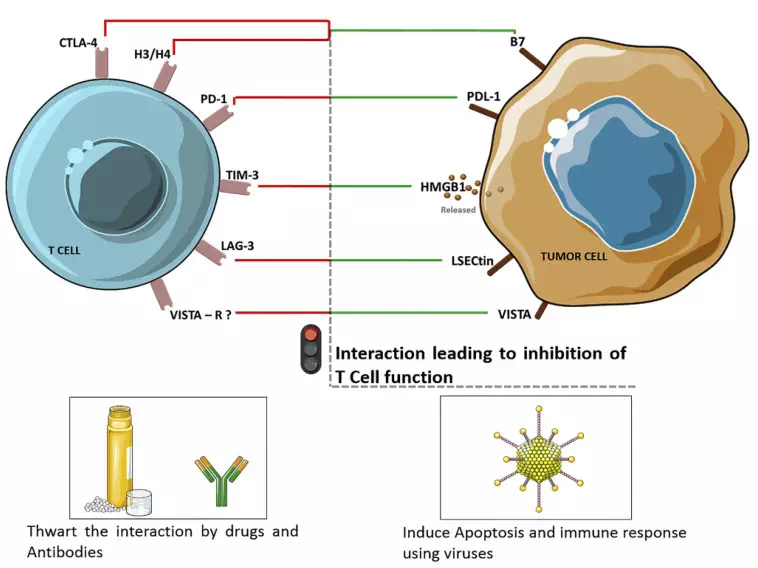
▲图2. 关闭T细胞的关键受体-配体相互作用
肿瘤免疫疗法的核心就是破坏肿瘤细胞踩刹车功能。如图3所示,与T细胞的PD-1蛋白结合的是PD-1抑制剂,与肿瘤细胞的PD-L1蛋白结合的是PD-L1抑制剂,这样就像打残了肿瘤细胞踩刹车的脚,T细胞能持续识别出人体的肿瘤细胞并进行清除。
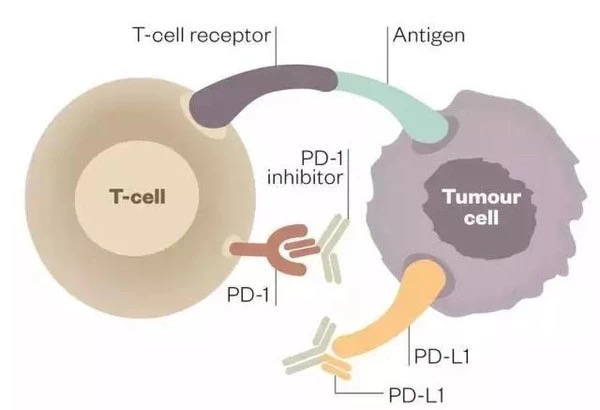
▲图3. PD-1/PD-L1抑制剂
如图2所示,CTLA-4(又称CD152)是T细胞表面的一种抑制分子受体,它与肿瘤上的B7配体结合后可以抑制淋巴结中原始T细胞的活化,导致T细胞反应减弱。CTLA-4抗体的目的是阻断CTLA-4与B7的结合,防止T细胞功能受到抑制。Ipilimumab是2011年FDA批准的一种CTLA-4分子抑制剂,用于治疗晚期黑色素瘤。
与CTLA-4相比,PD-1在炎症反应时表达更广泛,其功能是限制外周组织中T细胞的活性,以减少潜在的自身免疫。因此,阻断PD-1通路可增强抗肿瘤免疫反应。PD-L1和PD-L2是PD-1的主要配体。PD-L1在大多数黑色素瘤、卵巢癌和肺癌中都有高表达,此外,PD-L1通常在肿瘤微环境中的髓细胞上高表达,这表明PD-L1是肿瘤微环境免疫反应的结果。近年来,多种PD-1和PD-L1抗体药物被开发出来。如Pembrolizumab是2014年FDA批准的第一种治疗黑色素瘤的PD-1抑制剂,后来与Nivolumab联合用于治疗转移性非小细胞肺癌和头颈部鳞状细胞癌。此外,Atezolizumab是一种完全人源化的抗PD-L1的IgG1抗体,FDA于2016年批准用于治疗尿路上皮癌和非小细胞肺癌。
淋巴细胞活化基因-3(LAG-3)是另一种免疫检查点受体,它在活化的NK细胞和CD4+/CD8+T细胞中上调表达,对主要的组织相容性复合物(MHC)II有很高的亲和力。LAG-3的抗体可作为单一疗法或与其他检查点抑制剂联合治疗。例如,可溶性LAG-3Ig融合蛋白在肾癌晚期患者的试验中,接受高剂量药物治疗的患者耐受性良好,病情稳定。
TIM-3是TIM基因家族的一员,在调节免疫应答中起着关键作用,并在Th1、Th17和CD8+T细胞上表达(图3)。在癌症患者中,给予TIM-3抗体可增加肿瘤抗原特异性T细胞的增殖和细胞因子的产生。TIM-3的临床前研究表明,它与PD-1一起在肿瘤浸润性淋巴细胞上表达,并且针对这两个结构域的联合治疗可能会增加抗肿瘤反应。
溶瘤病毒与免疫检查点抑制剂联合
溶瘤病毒被设计成靶向并杀死肿瘤细胞,释放肿瘤抗原,刺激抗肿瘤免疫反应,而这正好是PD-1等免疫检查点抑制剂的局限所在,当肿瘤微环境缺少T细胞时,PD-1等免疫检查点抑制剂便无能为力。溶瘤病毒可将缺少免疫效应细胞一个“冷”的肿瘤微环境转化为一个增加免疫细胞和细胞因子浸润的“热”的环境。因此,目前有多个溶瘤病毒治疗和免疫检查点抑制剂联合用药的临床试验正在进行(表2)。
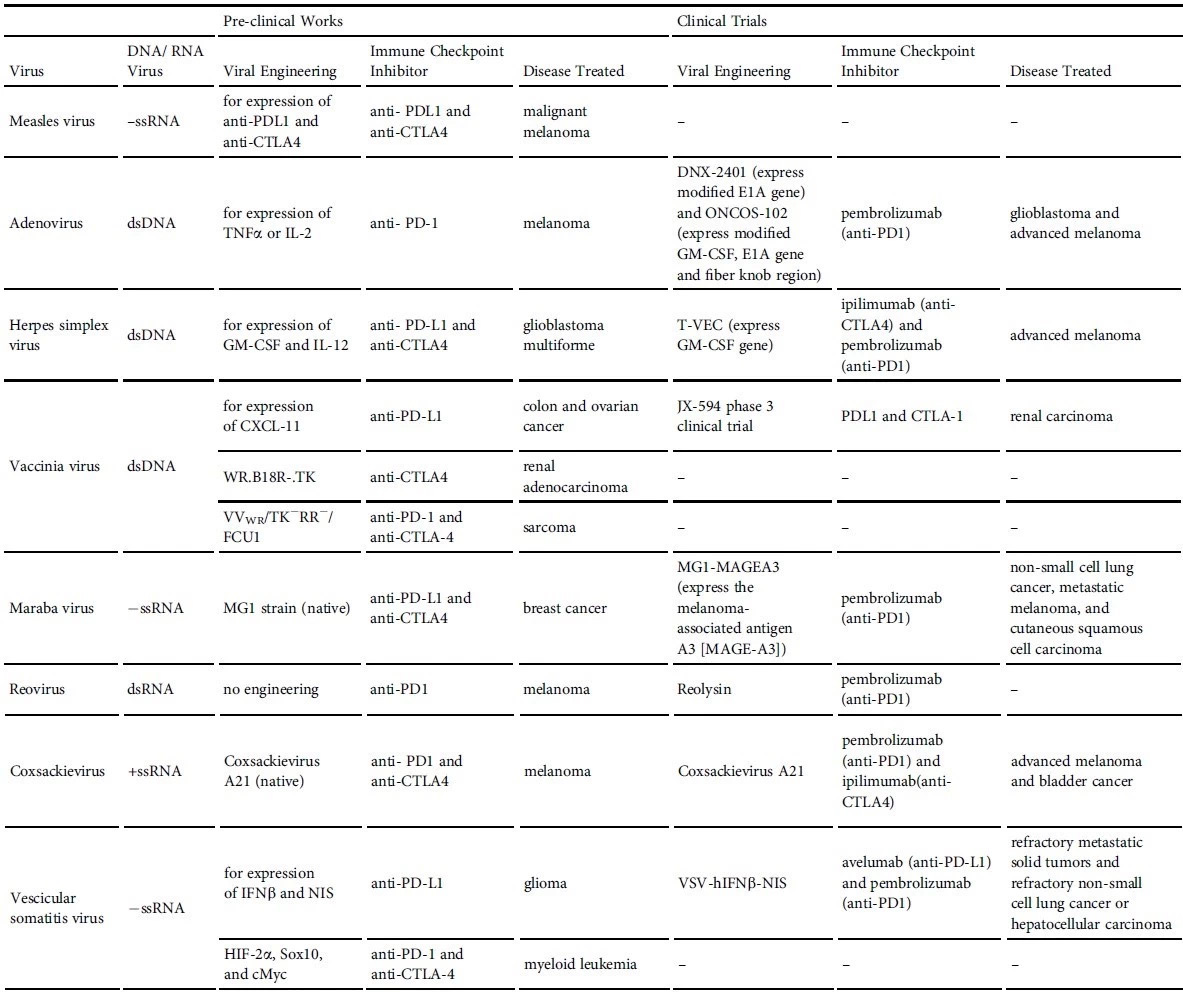
▲表2. 溶瘤病毒与免疫检查点抑制剂联合用药的临床前和临床试验
HSV-1是巨大的二十面体、双链DNA病毒,基因组约160 kb,含药物敏感性胸苷激酶(tk)自杀基因。癌症治疗基因可通过复制缺陷的HSV-1传递表达,包括:P53、金属蛋白酶组织抑制剂2(TIMP-2)、白细胞介素-2(IL-2)、白细胞介素-12、干扰素-γ和粒细胞-巨噬细胞集落刺激因子(GM-CSF)等。
Imlygic(Talimogenelaherparepvec,简称T-Vec)是FDA批准的第一个溶瘤病毒药物,主要用于晚期黑色素瘤的肿瘤的治疗。与野生型HSV1相比,Imlygic在巨细胞病毒启动子下表达人粒细胞-巨噬细胞集落刺激因子(GM-CSF),敲除了ICP34.5神经毒力基因和ICP47免疫逃逸基因,增强了Imlygic的肿瘤靶向性及杀伤效果。T-VEC对晚期不可切除黑色素瘤患者的治疗效果显著(16.2% vs. 2.1%;p<0.001)。此外,转移性黑色素瘤病灶内注射T-VEC可减少髓源性抑制细胞、CD4+Tregs和其它抑制细胞。免疫微环境的这些变化为T-VEC的联合用药奠定了基础。Ipilimumab是一种单克隆抗体,能有效阻滞CTLA-4分子,与T-VEC联合用药的Ib期临床试验结果显示黑色素瘤患者达到50%的有效缓解。II期试验198名患者接受T-VEC与Ipilimumab联合治疗,结果显示联合治疗组的有效率(39%)明显高于单一治疗组(18%)。更重要的是,52%的患者产生了远位治疗效应。
T-VEC与PD-1抗体联合治疗也取得了令人鼓舞的结果。在临床I期试验中,21例IIB期和Ⅳ期黑色素瘤患者采用T-VEC联合静脉注射Pembrolizumab,结果显示总的缓解率为62%,33%的患者完全缓解,联合治疗后PD-L1蛋白表达升高,肿瘤细胞中CD8+ T细胞增多,暗示溶瘤治疗可通过改变肿瘤微环境来提高抗PD-1治疗的疗效。
痘病毒是大型包膜的双链DNA病毒,使用痘苗病毒作为溶瘤病毒可静脉注射,具有稳定性好、传递性强、安全性高等优点。Liu等人证明在结肠癌和卵巢癌小鼠模型中,感染了tk和vgf基因缺失的溶瘤痘苗病毒后,PD-L1的表达水平明显高于注射对照组。在结肠癌和卵巢腹膜癌模型中,表达趋化因子CXCL11的溶瘤痘苗病毒和PD-L1抗体联用显示出协同效应,与单一疗法相比,这在统计学上都具有显著的生存优势。Rojas等研究显示肾腺癌模型小鼠经溶瘤痘苗病毒(TK和B18R基因缺失)注射4天后注射CTLA4抗体,与接受单一病毒治疗的小鼠相比,存活时间显著增加,肿瘤体积显著减少(P<0.04)。
腺病毒是Adenoviridae家族的双链DNA病毒,缺乏病毒包膜但具有二十面体衣壳结构,大小约为70~90 nm,基因组约35 kb。Hemminki报道了分别表达肿瘤坏死因子α(TNF-α)和IL-2的腺病毒,在小鼠侧腹黑色素瘤进行的体内实验中,他们发现与PD-1抗体联合使用时(与腺病毒相比),肿瘤内CD8+T细胞显著增加,并显著抑制肿瘤生长提高存活率。
小编总结
近年来,人们对肿瘤免疫学相关机制,特别是肿瘤微环境(TME)的免疫抑制特性有了新的认识,TME介导了肿瘤免疫应答的逃逸。现已证明溶瘤病毒提供的促炎刺激可一定程度上克服TME的免疫抑制,从而引起系统的抗肿瘤免疫反应。溶瘤病毒与免疫检查点抑制剂的联合治疗有望发挥两者协同作用,两者是一个很好的补充。另外,尽管T-VEC在黑色素瘤关键III期临床试验能够缩小肿瘤体积并触发系统性免疫反应,但却未能显著改善总生存期。从侧面表明,溶瘤病毒作为一种单药疗法的效果可能不是特别出色,因此开发联合用药可能是未来重要发展方向。
参 考 文 献
[1] Fourcade J, Sun Z, Benallaoua M, et al. Upregulation of Tim-3 and PD-1 expression is associated with tumorantigen-specific CD8+ T cell dysfunction in melanoma patients[J]. Journal of Experimental Medicine, 2010, 207(10):2175-2186.
[2] Sakuishi K, Apetoh L, Sullivan J M, et al. Targeting Tim-3 and PD-1 pathways to reverse T cell exhaustion andrestore anti-tumor immunity[J]. Journal of Experimental Medicine, 2011,208(6):1331-1331.
[3] Liu Z, Ravindranathan R, Kalinski P, et al. Rational combination of oncolytic vaccinia virus and PD-L1 blockade works synergistically to enhance therapeutic efficacy[J]. Nature Communications,2017, 8:14754.
[4] Rojas J J, Sampath P, Hou W, et al. Defining Effective Combinations of Immune Checkpoint Blockade and OncolyticVirotherapy[J]. Clinical Cancer Research, 2011, 21(24):5543-5551.
[5] Cervera-Carrascon V, Siurala M, SantosJ M, et al. TNFa and IL-2 armed adenoviruses enable complete responses byanti-PD-1 checkpoint blockade[J]. OncoImmunology, 2018, 7(5):e1412902.
[6] Bommareddy P K, Shettigar M, Kaufman H L. Integrating oncolytic viruses in combination cancer immunotherapy[J]. Nature Reviews Immunology, 2018.
[7] Sivanandam V, LaRocca, C J, Chen N G, Fong Y, & Warner S G. (2019). Oncolytic Viruses and Immune Checkpoint Inhibition: The Best of Both Worlds. Molecular Therapy-Oncolytics. doi:10.1016/j.omto.2019.04.003
[8] 陈思行. 庖丁解瘤(二):肿瘤免疫治疗. 医药投资并购俱乐部. 2019-08-06