来源:病毒学界
近日,美国生物化学学会会刊(The Journal of Biological Chemistry, JBC)在线发表了中国农业大学动物医学院夏春课题组李晓迎博士等最新研究成果:鸡MHC-I择优递呈高致病性禽流感 H5N1病毒(HPAIV)T细胞表位的结构学机制(Structures of the MHC-I molecule BF2*1501 disclose the preferred presentation of an H5N1 virus-derived epitope)。本文首先对已知的HPAIV主要毒株全病毒进行了扫描,并通过系列实验预选了其T细胞表位(CTL表位);随后,采用多肽免疫以及三维(3D)结构解析,详细阐述了HPAI H5N1一条高度保守的CTL表位,以及此表位被鸡pMHC-I择优呈递的结构学机制。
高致病性禽流感H5N1病毒的流行不仅对养禽业造成严重经济损失,而且对人类健康产生威胁。迄今为止,主要采用灭活疫苗防控禽流感。然而,由于禽流感病毒具有高度变异性的特点,灭活苗往往对变异毒株不能产生较好的免疫保护。与抗体免疫不同,由CD8+ T细胞介导的表位特异性免疫应答能够识别相对保守的CTL表位,对保有此表位的不同毒株以及变异株也可产生免疫保护。然而,目前尚无确切的禽流感病毒T细胞表位鉴定与应用相关报道,阻碍了基于T细胞免疫应答的表位疫苗开发,延缓了对鸡以及禽流感病毒特异性CD8+ T细胞免疫反应应答的深入研究。为此,本文以高致病性禽流感H5N1CTL表位为研究目标,通过系统筛选来源于不同毒株全蛋白的病毒多肽,从CD8+ T细胞识别与免疫应答水平鉴定出了具有高度保守性的T细胞表位PA123-130(图1)。

图1. PA123-130表位免疫后鸡的特异性CD8+ T细胞的检测
注:(A) 鸡的免疫程序及外周血淋巴细胞分离和检测示意图。(B) 流式细胞检测PA123-130表位特异性CD8+ T细胞。(C) PA123-130表位特异性CD8+ T细胞在多肽免疫组、灭活苗免疫组和空白对照组之间差异显著性分析
通过与其它源于禽流感病毒蛋白的多肽免疫和检测数据对比分析发现,PA123-130被B15品系鸡MHC-I分子BF2*1501择优递呈。为明确其分子结构机制,本文进一步解析了BF2*1501-PA123-130复合体的三维结构(pBF2*1501-PA123-130),并分析发现, pBF2*1501-PA123-130的多肽结合槽(PBG)口袋(C,D,E)空间大小或介于已知的BF2*2101和BF2*0401相应口袋大小之间(图2)。

图2. BF2*1501多肽结合槽口袋(蓝色)与BF2*0401(黄色)和BF2*2101(粉色)相应口袋大小与氨基酸组成比较
分析发现,pBF2*1501-PA123-130中等大小的PBG是由组成相应口袋的氨基酸所决定。其中,氨基酸Arg68、Thr69和Gly152、Leu153分别与BF2*0401和BF2*2101相应位置氨基酸存在部分相似性,决定了BF2*1501具有中等大小的多肽结合槽以递呈PA123-130表位多肽。pBF2*1501-PA123-130多肽结合槽B和F口袋为抗原多肽的锚定位点,相对较深且空间较大,趋向于结合具有长侧链(B口袋)或具有芳香族侧链(F口袋)的氨基酸(图3)。进一步分析B口袋的带电荷性质发现,B口袋显示负电荷(图3),说明B口袋对碱性氨基酸如精氨酸(Arg)和赖氨酸(Lys)具有选择偏好性。

图3. BF2*1501多肽结合槽具有较深的锚定口袋B和较大的锚定口袋F
注:(A)BF2*1501多肽结合槽锚定口袋B和F。(B)BF2*0401多肽结合槽锚定口袋。(C)BF2*2101多肽结合槽锚定口袋。组成口袋的氨基酸侧链均已标注,且与表位多肽形成氢键作用力的氨基酸加粗显示,氢键以黄色虚线标示。
除锚定口袋的限制性因素外,结合表位多肽N端氨基酸残基的A口袋同样影响表位与MHC-I分子的结合与递呈。首先,通过分析多肽与BF2*1501 PBG之间相互作用力(包括氢键、盐桥和范德华力)发现,抗原表位PA123-130 N端氨基酸残基Arg-1与A口袋之间的相互作用力仅次于Arg-2和Tyr-8与B口袋和F口袋的相互作用力,说明Arg-1与A口袋的结合对稳定的BF2*1501-PA123-130复合体的形成起重要作用。其次,Arg-1与BF2*1501 A口袋内的Glu62通过3个盐桥互作,与Tyr58通过一个氢键互作(图4),而这些相互作用力在已报道的其它鸡pBF2复合体中未被发现。最后,BF2*1501 A口袋呈现带负电荷的化学性质,决定了其更易结合碱性氨基酸,而排斥酸性氨基酸。这一点在多肽-BF2*1501复合体的体外复性实验中也进一步得到了证实。在筛选的一系列抗原多肽中,来源于禽流感H5N1病毒M2蛋白的多肽M243-51,其N端为酸性氨基酸天冬氨酸(Asp-1),该多肽则不能与BF2*1501形成稳定的复合体(图4)。

图4. BF2*1501多肽结合槽中A口袋与Arg-1的结合
注:(A)分析BF2*1501 A口袋与Arg-1的相互作用。(B)分析BF2*2101 A口袋与Arg-1的相互作用。(C)BF2*1501 A口袋呈现带负电荷的化学性质。(D)来源于H5N1的抗原多肽与BF2*1501体外复性效果检测。
尽管多肽与BF2*1501体外复性实验结果显示,大部分来源于H5N1的多肽均能与BF2*1501形成稳定的复合体,然而,多肽免疫鸡的结果进一步显示了PA123-130可被择优识别;并进一步推断BF2*1501-PA123-130具有能够被特异性TCR识别的结构特点。
本文进一步解析了BF2*1501结合自身肽CBP22-29的三维结构。对比两者的结构发现,PA123-130表位肽中氨基酸Tyr-7的长侧链突出于BF2*1501的多肽结合槽外,成为被TCR识别的一个关键点;而自身肽CBP22-29则不具备这一特征(图5)。
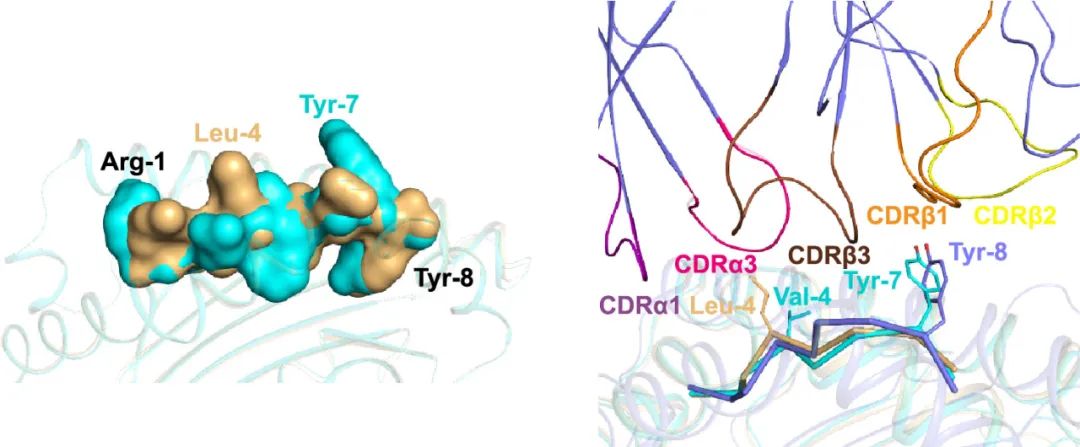
图5. BF2*1501递呈PA123-130和CBP22-29的结构比较
注:与CBP22-29相比,PA123-130具有突出于PBG的氨基酸Tyr-7(左侧)。通过与模拟分析,PA123-130中的Tyr-7可作为被特异性TCR识别的热点(右侧)。
综上所述,本文通过解析鸡BF2*1501-PA123-130复合体的精细结构,阐明了一T细胞表位可被择优递呈的分子机制。BF2*1501多肽结合槽中A、B和F口袋的氨基酸组成和化学性质决定PA123-130能够被稳定结合和递呈,而PA123-130的氨基酸结构特征则决定了是否可被CD8+ T细胞特异性识别。阐明鸡MHC-I分子择优递呈T细胞表位的结构学机制,为推进鸡的CTL免疫应答以及新型疫苗的研发提供了结构学平台与具体数据。
本研究为国家自然科学基金资助项目(No. 31572493,主持人夏春)。
原文链接:https;//www.jbc.org/content/early/2020/03/09/jbc.RA120.012713.abstract