来源:今又生细胞工程
2020年2月1日/医麦客新闻/eMedClub News/--根据Evaluate Pharma的卖方共识预测,从2017年的10亿美元增长到2024年的440亿美元,细胞治疗、基因治疗以及核酸疗法的全球市场规模复合年增长率达到惊人的65%。有了这样的市场价值预估,在过去的几年中,基因治疗已经成为并且将继续成为业务发展团体和行业观察家最关注的制药领域之一。
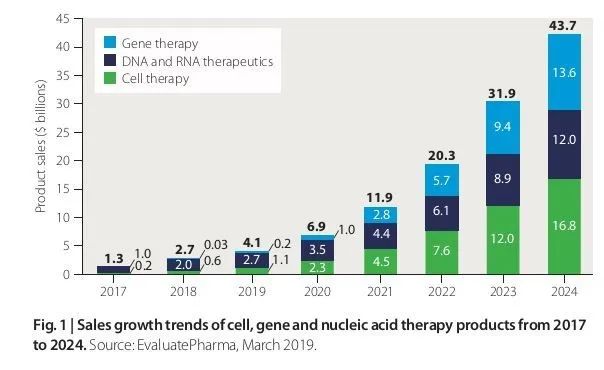
数据来源:BioPharmaDealmakers[1]; EvaluatePharma, March 2019
全球上市基因治疗产品已达20余种
随着基因治疗发展,基因治疗产品采用的载体安全性和有效性逐渐提升,陆续有多款基因治疗产品获批上市,全球各地区获批情况如下图。

如图所示,全球已有20多个基因治疗产品上市(其中2个产品目前已撤市),产品类型涉及寡核苷酸类、溶瘤病毒、CAR-T疗法、干细胞疗法以及其他基于细胞的基因疗法。
从Nature的文章“Gene Therapy Arrives”中,我们了解下主要的基因治疗市场药物。
基因插入
这些治疗方法使用无害病毒将良好的基因带入细胞,该病毒将其插入现有基因组中,从而消除了另一个基因中有害突变的影响。
Gendicine(今又生):重组人p53腺病毒注射液(Gendicine®/今又生®)是由深圳市赛百诺公司研发的携带有野生型p53基因的重组复制缺陷型人5型腺病毒,可通过表达抑癌基因p53,刺激机体产生特异性抗肿瘤免疫反应,上调多种抗癌基因和下调多种癌基因活性,从而瀑布性增强抑癌作用,特异地引起肿瘤细胞程序性死亡,从而实现杀伤肿瘤的目的[7]。该药为瘤内注射剂,于2003年在中国获批上市,主要用于治疗头颈部鳞状细胞癌,是全球首个抗肿瘤基因治疗产品。
2018年在“Human Gene Therapy”的特刊中,记录了第一个获批的癌症基因治疗药物:重组人腺病毒注射液(Gendicine)今又生临床12年综述。
从 2004 年获批后到 2016 年的 12 年间,赛百诺共生产了 41 批共计 169571 支今又生Gendicine(1.0x1012 个病毒颗粒每支)所有的药品都符合中国食品药品监督管理局的 QC/QA 标准。根据平均每个患者使用 5 支药品计算,超过 30000 名患者,其中 包括从 50 多个国家来的将近 10%的国际患者接受了今又生Gendicine的单独治疗或 同放化疗、热疗和其他多种疗法连用的治疗。总体上在各种临床应用和临 床研究中使用今又生治疗达到了 30-40% 的完全缓解率(complete response CR),50-60% 的部分缓解率(partial response PR),总的有 效率(CR + PR)达到了 90-96%,同 CFDA 批准的今又生 II 期 III 期临床 数据是一致的。到目前为止,用今又生Gendicine治疗中最常见的副反应是药品注射 后的发热、关节疼痛和肌肉疼痛。大约有 50-60%的患者在注射今又生Gendicine 24 小时后出现发热情况(37.5-39.50C),仅持续几个小时。

GLYBERA:在欧盟治疗脂蛋白脂肪酶缺乏症(LPLD)方面获得批准的首个基因疗法,这是一种罕见的遗传病,可导致严重的胰腺炎。该药物将脂蛋白脂肪酶基因插入肌肉细胞。但是由于LPLD发生在极少数患者中,因此该药物无利可图。到2017年,其制造商拒绝续签其销售授权;Glybera不再投放市场。
IMLYGIC:该药物已在中国,美国和欧盟获得批准,可用于治疗初次手术后出现皮肤复发的患者的黑色素瘤。Imlygic是一种通过病毒载体直接插入肿瘤的改良基因疗法,该基因在其中复制并产生刺激免疫反应杀死癌细胞的蛋白质。GLYBERA:在欧盟治疗脂蛋白脂肪酶缺乏症(LPLD)方面获得批准的首个基因疗法,这是一种罕见的遗传病,可导致严重的胰腺炎。该药物将脂蛋白脂肪酶基因插入肌肉细胞。但是由于LPLD发生在极少数患者中,因此该药物无利可图。到2017年,其制造商拒绝续签其销售授权;Glybera不再投放市场。
KYMRIAH:Kymriah是针对B细胞淋巴母细胞白血病(一种会影响儿童和年轻人的白细胞的癌症)开发的,Kymriah于2017年获得FDA批准,并于2018年获得欧盟批准。它的工作原理是将新基因引入患者的拥有自己的T细胞,使他们能够发现并杀死癌细胞。
LUXTURNA:该药物于2017年获得FDA的批准,于2018年获得欧盟的批准,用于治疗一种罕见的遗传性失明形式的患者,称为双等位基因RPE65突变相关性视网膜营养不良。该疾病在美国影响1,000至2,000名患者,这些患者的特定基因RPE65的两个拷贝均发生突变。Luxturna将RPE65的正常副本传递给患者的视网膜细胞,使他们能够制造将光转换为电信号并恢复视力所需的蛋白质。
STRIMVELIS:在欧洲,每年约有15名患者被诊断出患有严重的免疫缺陷,这是一种罕见的遗传性疾病,称为腺苷脱氨酶缺乏症(ADA-SCID)。这些患者的身体无法产生ADA酶,而ADA酶对健康的白细胞至关重要。Strimvelis于2016年在欧盟获得批准,其工作原理是将负责产生ADA的基因引入患者骨髓中提取的干细胞中。然后,这些细胞被重新引入患者的血液中,然后被运输到骨髓,并开始产生可以产生ADA的正常白细胞。
YESCARTA:Yescarta专为治疗称为大B细胞淋巴瘤的癌症而开发,于2017年获得FDA的批准,于2018年获得欧盟的批准,目前正在中国进行临床试验。大B细胞淋巴瘤会影响称为淋巴细胞的白细胞。该疗法是一种称为CAR-T细胞疗法的方法的一部分,它使用病毒将编码嵌合蛋白受体(CARs)的蛋白质的基因插入患者的T细胞中。当这些细胞重新引入患者体内时,CAR使它们能够附着并杀死血液中的癌细胞。
ZOLGENSMA: 2019年5月,FDA批准Zolgensma用于2岁以下患有脊髓性肌萎缩症的儿童,这是一种神经肌肉疾病,影响全球约10,000人。它是婴儿死亡的主要遗传原因之一。Zolgensma可通过单次治疗将健康的人类SMN基因拷贝传递给患者的运动神经元。
ZYNTEGLO:Zynteglo于2019年5月在欧盟获得批准,可治疗一种称为β地中海贫血的血液疾病,该疾病可降低患者产生血红蛋白的能力,血红蛋白是含铁的红细胞中的蛋白质,可导致危及生命的贫血。该疗法已被批准用于需要定期输血的12岁及12岁以上的个人。它利用一种病毒将健康的基因拷贝引入血红蛋白中,使血红蛋白进入患者的干细胞中,然后将这些细胞重新引入血液中并转运到骨髓中,在那里它们开始产生可以制造血红蛋白的健康红细胞。
基因干扰
这种方法使用RNA或DNA的合成链(称为寡核苷酸),将其引入患者细胞后,可以附着于特定基因或其信使分子,从而有效地使其失活。一些治疗方法使用一种反义方法,该方法以一条DNA链命名,而其他方法则依赖于小的干扰RNA链,从而阻止了从基因到细胞蛋白工厂的指令分子。
DEFITELIO:此药物包含从猪肠粘膜获得的单链寡核苷酸的混合物。它已于2017年在美国和欧盟获得批准(有限制),用于治疗接受骨髓移植的患者的严重静脉闭塞性疾病。静脉闭塞性疾病是一种导致肝小静脉阻塞的疾病。
EXONDYS 51:由于其功效存在一些争议,FDA在2016年批准了Exondys 51。FDA审查小组的两名成员辞职以抗议该决定。该疗法旨在治疗因RNA突变引起的杜兴氏肌营养不良症,该突变编码的蛋白质有助于将肌肉纤维的细胞骨架连接到周围的基质。Exondys 51可有效治疗约13%的Duchenne人群。
KYNAMRO:Kynamro于2013年获得FDA批准,旨在抑制或有效地关闭有助于生产低密度脂蛋白(LDL)的蛋白质的生产。皮下注射该疗法可降低胆固醇危险高的患者的低密度脂蛋白水平。
Macugen:与年龄有关的黄斑变性是60岁及以上人群视力丧失的主要原因。这是由于血管渗漏导致视网膜中心变坏所致。Macugen已在美国获得批准,可抑制这些血管在视网膜下生长,从而治疗该疾病。
SPINRAZA:在2016年获得FDA批准后,Spinraza成为首个基于基因的脊柱肌肉萎缩疗法。遗传性疾病是由SMN含量低引起的,SMN是维持运动神经元的关键蛋白。Spinraza与来自称为SMN2的“备用”基因的RNA结合,将该RNA转换为制备功能齐全的SMN蛋白的指令。
综上,目前全球共批准上市20余款基因治疗产品,但其中仅有很少一部分在中国获批上市,未来中国基因治疗行业发展空间巨大。




