点击图片,报名参会
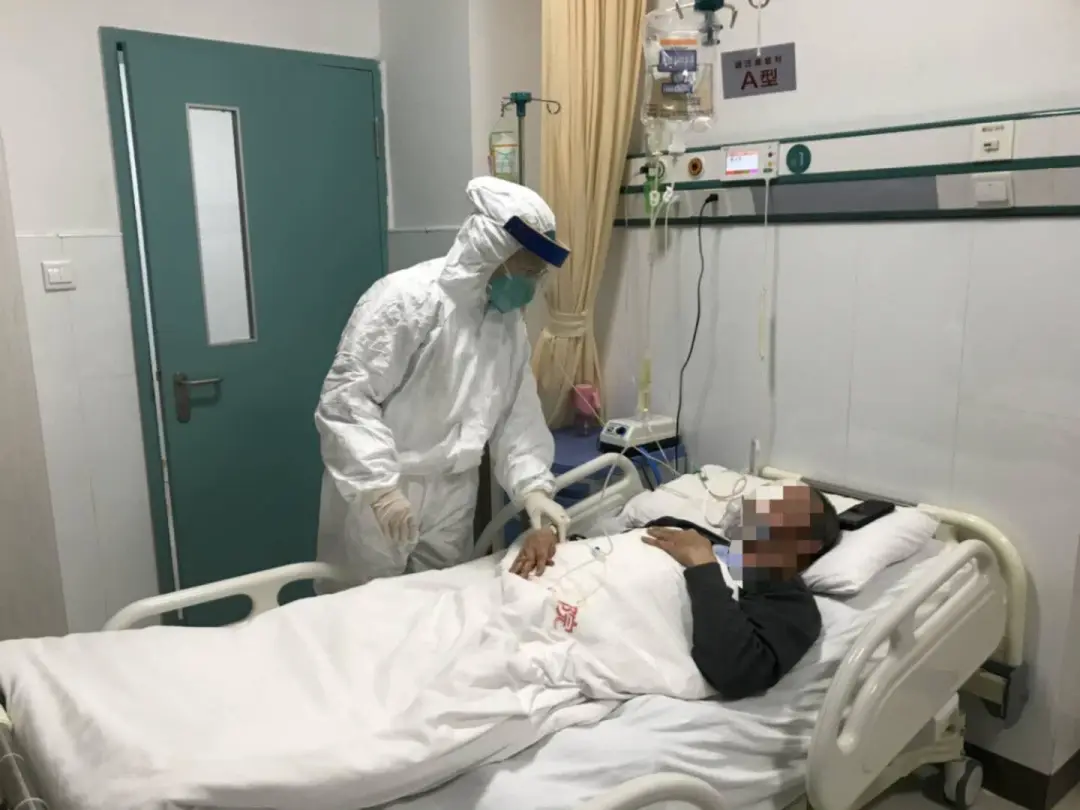
2021年9月22日/医麦客新闻 eMedClub News/--2021年9月21日,蓝鸟公司(bluebird bio)宣布已完成其基因治疗产品betibeglogene autotemcel (beti-cel)在FDA的滚动提交生物制剂许可申请(BLA)。
betibeglogene autotemcel(beti-cel)是一款使用BB305慢病毒载体(LVV)制造的一次性基因疗法,适用于所有基因型的成人、青少年和儿童输血依赖型β-地中海贫血(TDT)患者。
BB305LVV是第三代自灭活LVV,包含一个细胞(非病毒)调控元件,称为启动子,仅在红细胞谱系(RBC及其前体)中驱动基因表达。
bluebird bio严重遗传疾病总裁Andrew Obenshain说:“通过提交这份文件,我们离为TDT患者及其家人带来潜在的变革性基因疗法又近了一步。在bluebird bio,我们对基因疗法有着深刻的理解,在严重的遗传疾病方面进行了十多年的研究和开发。我们期待与FDA合作审查该BLA,因为我们能意识到一次性基因疗法对患者的承诺。”
beti-cel将修饰过的β-珠蛋白基因拷贝添加到患者自身的造血干细胞中(HSC)。患者拥有βA-T87Q珠蛋白基因后,他们就有可能产生HbAT87Q,这是一种基因治疗衍生的成人血红蛋白(Hb),其水平可以消除或显着减少输血需求。
在beti-cel研究中,不依赖输血(TI)被定义为至少12个月不再需要输血红细胞,同时维持至少9g/dL的加权平均Hb。在3期临床试验中,89%(32/36)跨年龄和基因型的可评估患者达到了TI,其中包括年仅4岁的儿科患者和基因型最严重的的患者。
beti-cel的BLA提交基于蓝鸟生物多个临床试验中的患者数据,包含超过220个患者年。截至2021年3月9日,结果包括总共63名接受beti-cel治疗的β0/β0和非β0/β0基因型的儿童、青少年和成人患者。数据包括对2名患者长达七年的随访,8名至少六年的随访和19名至少五年的随访,近期公布在第26届欧洲血液学年会(EHA2021 Virtual)上。
蓝鸟的基因疗法之路
在美国,FDA此前授予了beti-cel孤儿药和突破性疗法认定。若此次获批,beti-cel将成为美国首个造血(血液)干细胞(HSC)体外基因疗法。
除Zynteglo之外,蓝鸟已上市的产品还有SKYSONA(elivaldogene autotemcel)和ABECMA(idecabtagene vicleucel)。
Skysona是一种造血干细胞慢病毒体外基因疗法,利用Lenti-D慢病毒载体(LVV)进行体外转导,将ABCD1基因的功能拷贝添加到患者自身的造血干细胞(HSC)中。
2021年7月,欧盟委员会(EC)授予SKYSONA™(elivaldogene autotemcel,Lenti-D™)上市许可,可用于治疗年龄在18岁以下,携带ABCD1基因突变、没有HLA匹配的同胞造血干细胞(HSC)供体可用、早期脑肾上腺脑白质营养不良(CALD)患者。Skysona是第一个也是唯一一个获批用于治疗CALD的一次性基因疗法。
2018年7月EMA授予Skysona治疗CALD的优先药物资格(PRIMC),此前还授予了孤儿药资格(ODD)。
2021年2月,因试验中两名患者分别出现了急性髓细胞白血病(AML)和骨髓增生异常综合征(MDS),蓝鸟在镰状细胞病中的1/2期临床试验被叫停。
2021年3月11日,蓝鸟宣布,经过与独立专家合作进行的调查,分析结果显示基因疗法中使用的慢病毒载体BB305导致患者得上AML的可能性很低。所以6月时,蓝鸟解除了Zynteglo的销售暂停,并宣布FDA已解除其镰状细胞病和β-地中海贫血基因疗法的临床试验控制。
但在2021年8月,蓝鸟的2021Q2财报中提到,FDA再次暂停了eli-ce用于脑肾上腺脑白质营养不良(CALD)的3期临床试验,一份骨髓增生异常综合征(MDS)疑似意外严重不良反应(SUSAR)的报告显示,其使用的载体慢病毒Lenti-D的特定设计特征,可能是受试者患上MDS的促成因素。
这一不良事件的发生,也许只是蓝鸟所使用的慢病毒载体的特定设计与受试者个体产生了某些冲突而导致,但其具体原因还需分析结果公布后才能定论。
蓝鸟同一病毒载体两次引发关注,无疑凸显了基因治疗中病毒载体的安全问题,也是患者、监管和企业最关注的的问题。在基因治疗的不断创新过程中,如何应对可能的基因组整合、突变等问题,是生物制药研发需要更好探索并规范化的。
ABECMA则是bluebird和BMS联合开发的一款靶向BCMA的CAR-T产品。
2021年3月,ABECMA在美国获FDA加速批准上市,成为美国FDA批准的首个靶向BCMA的CAR-T细胞治疗。2021年8月,该产品已获得欧盟委员会(EC)授予的有条件上市许可。其目标患者为至少接受过三种免疫疗法的复发/难治性多发性骨髓瘤(r/r MM)成年患者。
参考资料:
1.https://www.businesswire.com/news/home/20210921005978/en