2021年8月19日/医麦客新闻 eMedClub News/--驯鹿医疗自主研发的新一代CAR-T产品CT125A的临床前研究结果,近期在世界权威学术期刊《Molecular Therapy》(分子治疗)中发表。CT125A是一款具有first-in-class意义的创新CAR-T产品,也是公司基于全人源抗体库开发的针对T细胞血液瘤的具有里程碑意义的产品。
文章发表截图 (图片来源:《Cell》官网)
《Molecular Therapy》是世界最权威的学术杂志之一《Cell》的子刊,是美国基因与细胞治疗学会的官方杂志。《Molecular Therapy》致力于发表重要的同行评议研究和前沿评论,并促进遗传学、医学和生物技术科学的发展。2021年该杂志的影响因子为11.454。
本次发表的研究由驯鹿医疗与华中科技大学同济医学院附属同济医院周剑峰教授团队合作进行。驯鹿医疗戴振宇博士、穆伟博士为共同第一撰稿人,驯鹿医疗研发执行总监谭涛超博士为CT125A项目前期开发负责人。
研究亮点:治疗T细胞恶性肿瘤的新策略
研究人员成功应用噬菌体展示技术筛选出靶向CD5抗原的全人源单域抗体,并应用CRISPR/Cas9技术敲除了T细胞的CD5,解决了CAR-T细胞自激活和自相残杀的问题;通过一系列体外及体内功能验证了串联使用针对不同表位的VH可以增强CAR-T细胞的功能的假设:CT125A的全人源单域双表位FHVH3/VH1 CAR-T为T细胞恶性肿瘤的治疗提供了一种新的策略。
CD5:对抗T细胞肿瘤的新型、安全可靠的靶点
嵌合抗原受体T细胞(CAR-T)技术在近几年取得了突破性进展,尤其在针对B细胞恶性肿瘤的靶点上取得了巨大的成功,但其在T细胞恶性肿瘤的研究及应用非常有限。T细胞恶性肿瘤包括急性T淋巴细胞白血病(T-ALL)和T细胞淋巴瘤(TCL)(1)。CD5在大约85%的T细胞恶性肿瘤中高度表达,而CD5在人体正常细胞的表达仅限于胸腺细胞、T细胞和B1细胞。此外,CD5在一些B细胞恶性肿瘤中也有表达。因此,CD5可以作为T细胞肿瘤和部分B细胞肿瘤的治疗靶点。目前,只有少数靶向CD5的治疗方法在开发中,且都在早期阶段。
突破性的全人源单域双表位结构:更强、更持久的杀瘤功能,免疫原性更低
本研究从驯鹿自有的高质量IMARS全人源抗体库筛选获得多个特异性结合CD5抗原的抗体(包含scFv和VH only domain),并将这些特异抗体构建成CAR-T,并在CAR-T水平进行候选分子筛选。为了解决CAR-T自杀的问题,研究人员应用CRISPR/Cas9技术敲除了T细胞CD5基因,并优化了制备的工艺,实现了高效的CD5敲除和高质量的CAR-T制备。在此基础上,筛选到了若干体外杀伤功能和扩增能力都比对照CAR (H65)更优的候选克隆。
在候选克隆中,研究人员通过表位竞争实验发现了FHVH1和FHVH3具有不同的CD5抗原结合表位。为了进一步提高药效,并减少由于抗原突变或表达下调导致的逃逸,研究人员进一步开发并优化了双VH串联的胞外结构。最后优选的双表位CAR(FHVH3/VH1)与单独的FHVH1、FHVH3 CAR对照H65相比,对CD5+细胞,尤其是较低CD5表达强度的靶细胞,表现出更高的脱颗粒水平和杀伤能力。在小鼠肿瘤模型中,FHVH3/VH1 CAR-T细胞比FHVH1和FHVH3 CAR-T细胞能更早地清除T-ALL细胞,并能比FHVH1和FHVH3 CAR-T细胞维持更长的缓解期,证明针对不同表位的FHVH3/VH1 CAR-T细胞具有更强且更持久的杀瘤功能。
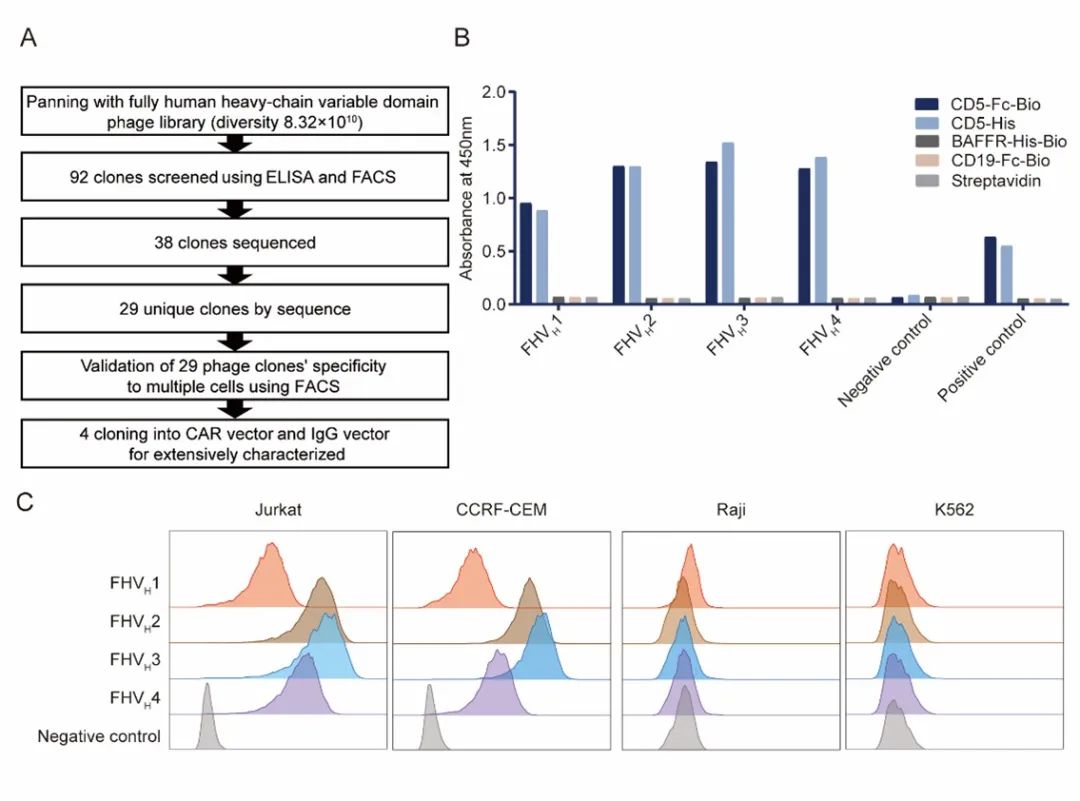
图1:噬菌体展示技术筛选和鉴定全人源CD5特异性重链可变域(VH)。A:CD5特异性VH发现过程的示意图。B:代表性噬菌体克隆和KO7(阴性对照噬菌体)的结合活性。用小鼠抗M13抗体和HRP-山羊抗小鼠IgG抗体染色后检测与不同抗原的结合,然后在450nm处读取光密度值。小鼠抗CD5抗体+HRP-山羊抗小鼠IgG抗体被用作阳性对照。C,噬菌体克隆FHVH1-4与Jurkat和CCRF-CEM(均为CD5+)细胞结合,但不与Raji和K562(均为CD5-)细胞结合。
图2:CD5 CAR-T细胞在SUP-T1建立的肿瘤模型中的体内抗肿瘤活性。A:各治疗组在指定时间点的小鼠肿瘤负担。结果显示为平均值±SEM(n = 6)。B:通过生物发光成像监测肿瘤的生长和分期。
CT125A:有望为T细胞恶性肿瘤患者带来新的希望
与B细胞恶性肿瘤相比,T细胞恶性肿瘤放化疗后复发率更高、预后更差,存在巨大的未被满足的临床需求。CT125A是一款具有first-in-class意义的创新CAR-T疗法,有望为难治复发的T细胞恶性肿瘤的患者带来新的希望;另外,CD5在一些难治的B细胞恶性肿瘤,如B-CLL和MCL也有很高表达率,本产品将来可拓展到这些适应症,具有广阔的市场前景。
驯鹿医疗首席科学官郑彪博士表示:
“目前T细胞恶性肿瘤放化疗后复发率高、预后差,是临床较难治愈的血液系统恶性肿瘤,亟需开发针对该疾病的细胞治疗药物。本产品采用基因编辑技术敲除T细胞的CD5来避免CAR-T细胞的自激活和自杀问题;同时应用靶向CD5抗原的全人源单域抗体来控制抗抗体的产生;从而解决了靶向CD5 CAR-T细胞在患者体内存续时间短而导致疾病复发的问题。
研究结果表明CD5 CAR-T细胞在既往多线治疗的r/r CD5+T-ALL和T-NHL患者中是安全的,且能产生显著的临床疗效。重要的是,通过CD5 CAR-T细胞清除恶性T细胞或许能使既往不适合移植的患者接受HSCT。由于CD5还在一部分B细胞恶性肿瘤有高表达,本产品亦可用于包括套细胞淋巴瘤和慢性淋巴细胞白血病在内的B细胞肿瘤。此外具有显著意义的是,应用CAR-T细胞同时靶向两个或多个抗原位点在治疗及预防由于抗原丢失所导致的复发是一个非常有用的策略。全人源双位点单域抗体在本产品中的应用大大简化了双特异性CAR结构的设计,解决了肿瘤克隆异质性及抗原逃逸所带来的临床上的重大课题。”
目前,CT125A处于CMC研究和研究者发起的临床研究阶段(ClinicalTrials.gov: NCT04767308)
参考文献:
1.Alcantara M, Tesio M, June CH, Houot R. CAR T-cells for T-cell malignancies: challenges in distinguishing between therapeutic, normal, and neoplastic T-cells. Leukemia. 2018;32(11):2307-15.
医麦客始终致力于生物创新药的前沿技术、行业动态、产业洞察等原创新闻报道,全媒体高端矩阵用户达16万+,其中工业用户占比超50%,科研与临床用户约为30%,投资机构用户超过5%。为促进产业细分领域的互动交流,我们组建了多个专业微信群,欢迎扫码加群。